La energía interna de un sistema se refiere a la suma de las energías de todas sus partículas. En el caso de un gas ideal, la energía interna depende únicamente de la temperatura del sistema. Esto se debe a que las moléculas de un gas ideal solo tienen energía cinética y los choques entre las moléculas se consideran perfectamente elásticos.
En un gas ideal, las moléculas se mueven de manera aleatoria y chocan entre sí y con las paredes del recipiente que las contiene. Estos choques cambian la dirección de la velocidad de las moléculas y, por lo tanto, su momento lineal. El efecto de un gran número de colisiones en un período de tiempo se puede representar como una fuerza que actúa sobre la superficie de las paredes del recipiente.
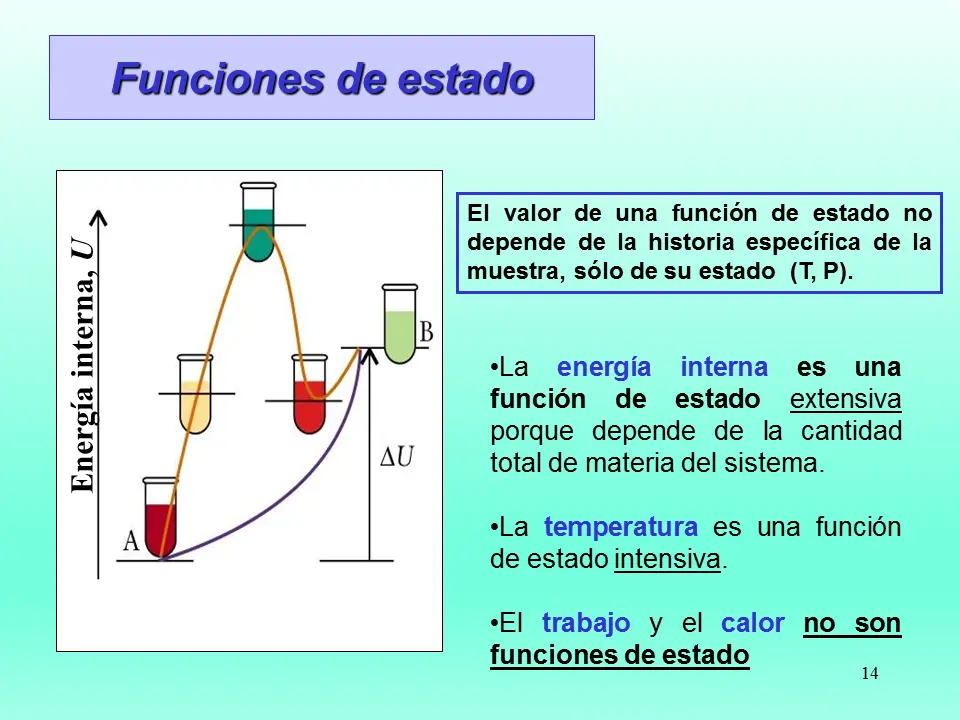
Si el sistema realiza trabajo, es decir, si se expande y aumenta su volumen, su energía interna disminuye. Por otro lado, si se realiza trabajo sobre el sistema, es decir, si se comprime y disminuye su volumen, su energía interna aumenta. Esto se puede expresar matemáticamente mediante la ecuación:
dW = -pdV
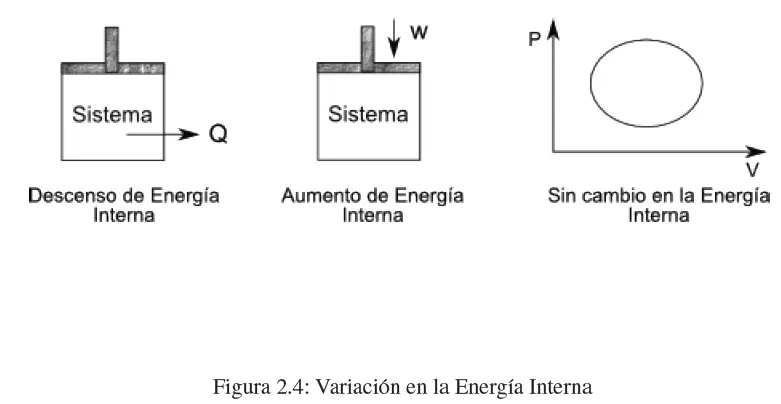
Donde dW es el trabajo realizado por el sistema, p es la presión del sistema y dV es el cambio en el volumen del gas.
Además del trabajo, la energía interna de un sistema también puede cambiar debido a la transferencia de calor. El calor es una forma de transferencia de energía que se produce debido a las diferencias de temperatura entre el sistema y su entorno. Si el sistema absorbe calor, su energía interna aumenta, mientras que si cede calor, su energía interna disminuye.
La energía interna de un sistema depende solo de su estado, es decir, de sus variables macroscópicas como la presión, el volumen y la temperatura. Estas variables macroscópicas se pueden representar en un diagrama p-V. Un sistema puede pasar de un estado inicial a un estado final a través de una serie de estados de equilibrio, y la energía interna del sistema en cada estado se representa como un punto en el diagrama p-V.
La energía interna también se puede expresar en función del cambio en la temperatura del sistema. Si la temperatura del sistema aumenta de TAa TB, la cantidad de calor absorbida se puede calcular multiplicando la masa (o el número de moles) por el calor específico y por la diferencia de temperatura:
Q = nc(T B- T A)
Donde Q es el calor absorbido, n es el número de moles, c es el calor específico y T es la temperatura.
La energía interna de un sistema depende únicamente de su estado, que se caracteriza por variables macroscópicas como la presión, el volumen y la temperatura. El trabajo realizado y la transferencia de calor son las dos formas en las que la energía interna de un sistema puede cambiar, pero la energía interna en sí misma solo depende del estado del sistema.
¿Qué es la energía interna de un sistema?
La energía interna de un sistema se refiere a la suma de las energías de todas sus partículas. En el caso de un gas ideal, la energía interna depende únicamente de la temperatura del sistema.
¿Cómo cambia la energía interna de un sistema?
La energía interna de un sistema puede cambiar debido al trabajo realizado por el sistema y a la transferencia de calor. Si el sistema realiza trabajo, su energía interna disminuye, mientras que si se realiza trabajo sobre el sistema, su energía interna aumenta. Si el sistema absorbe calor, su energía interna aumenta, mientras que si cede calor, su energía interna disminuye.
¿La energía interna depende solo del estado del sistema?
Sí, la energía interna de un sistema depende únicamente de su estado, que se caracteriza por variables macroscópicas como la presión, el volumen y la temperatura. La energía interna en sí misma no depende de cómo el sistema llegó a ese estado, solo del estado en sí.
La energía interna de un sistema depende solo de su estado y se refiere a la suma de las energías de todas sus partículas. En el caso de un gas ideal, la energía interna depende únicamente de la temperatura del sistema. La energía interna puede cambiar debido al trabajo realizado por el sistema y a la transferencia de calor. El trabajo realizado por el sistema provoca un cambio en el volumen del sistema, lo que a su vez afecta a su energía interna. Por otro lado, la transferencia de calor entre el sistema y su entorno también afecta a la energía interna del sistema. La energía interna de un sistema depende únicamente de su estado y puede cambiar debido al trabajo y al calor.