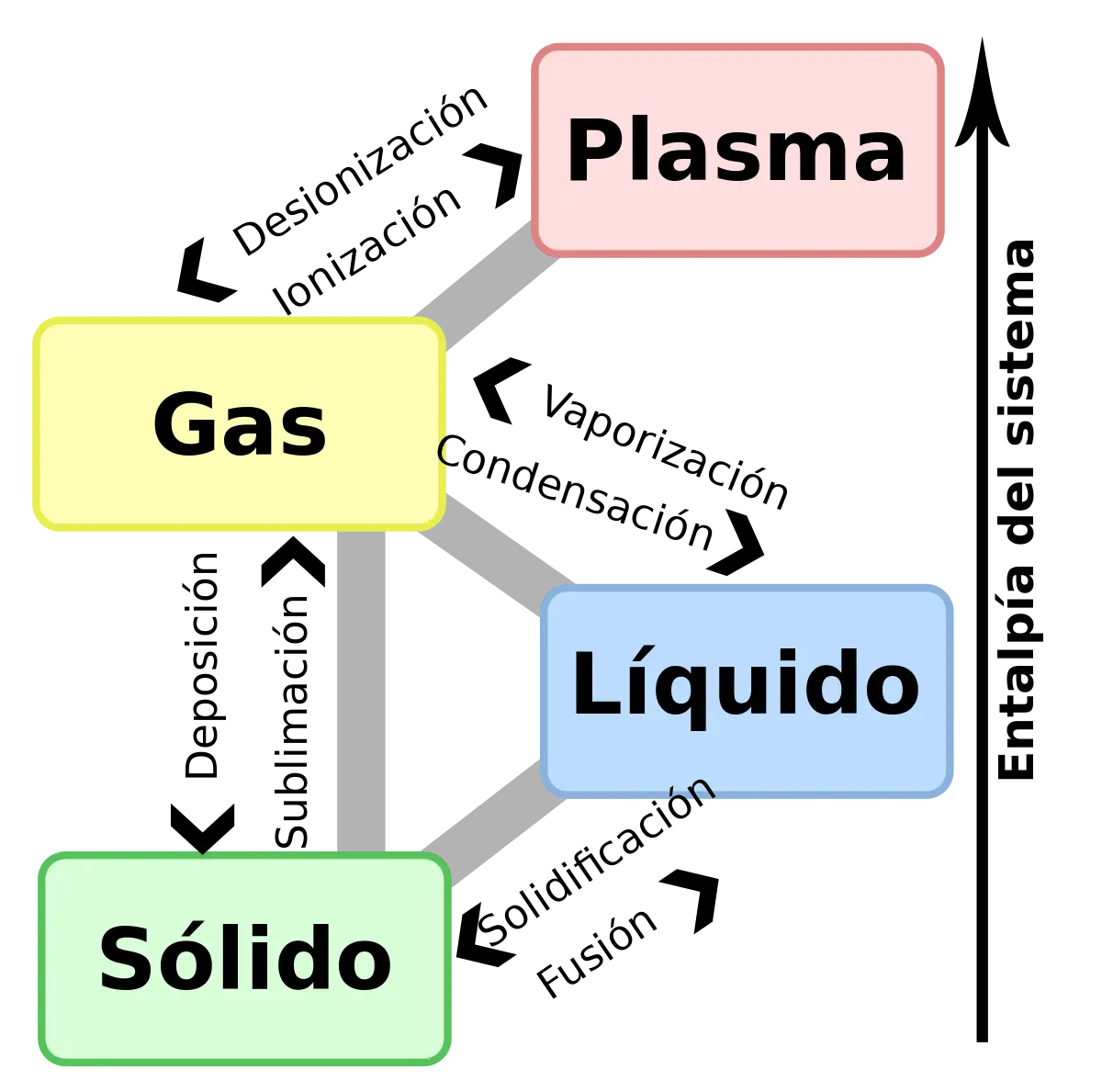
La fusión es un proceso físico en el cual una sustancia pasa del estado sólido al estado líquido. Esto ocurre cuando se aumenta la energía interna del sólido, generalmente aplicando calor o presión, lo que eleva la temperatura de la sustancia hasta alcanzar su punto de fusión. En este punto, la estructura ordenada de iones o moléculas en el sólido se vuelve menos ordenada, y el sólido se convierte en líquido.
¿Qué sucede con las moléculas durante la fusión?
Para comprender mejor el proceso de fusión, es importante entender cómo se comportan las moléculas durante este proceso. Cuando se aplica calor a un sólido, la energía térmica aumenta y las moléculas comienzan a vibrar con mayor intensidad. A medida que la temperatura se acerca al punto de fusión, estas vibraciones se vuelven más intensas y las fuerzas que mantienen unidas a las moléculas se debilitan.
En el punto de fusión, las moléculas tienen suficiente energía para superar las fuerzas de atracción intermoleculares y romper las estructuras cristalinas del sólido. Esto permite que las moléculas se muevan libremente, lo que resulta en la transición al estado líquido. Es importante destacar que la fusión es un proceso reversible, lo que significa que un líquido puede solidificarse nuevamente al enfriarse.
Factores que afectan la fusión
Existen varios factores que pueden influir en la fusión de un sólido:
- Temperatura: La temperatura es el factor principal que determina si un sólido se funde o no. Cada sustancia tiene un punto de fusión específico, que es la temperatura a la cual la sustancia cambia de sólido a líquido.
- Presión: La presión también puede afectar el punto de fusión de una sustancia. En general, un aumento en la presión aumenta el punto de fusión, mientras que una disminución en la presión disminuye el punto de fusión.
- Composición química: La composición química de un sólido puede influir en su punto de fusión. Algunas sustancias tienen enlaces más fuertes que requieren más energía para romperse, lo que resulta en puntos de fusión más altos.
Efectos termodinámicos de la fusión
Desde el punto de vista de la termodinámica, la fusión se considera una transición de fase de primer orden. Esto significa que hay cambios en la entalpía y la entropía durante el proceso de fusión, pero la energía libre de Gibbs se mantiene constante. La temperatura a la cual ocurre la fusión depende de la presión ambiental.
Es importante destacar que hay algunas excepciones a este comportamiento. Por ejemplo, el helio a bajas temperaturas tiene una entalpía de fusión negativa, lo que significa que se debe extraer calor para fundirlo. Sin embargo, estas excepciones son poco comunes.
Superenfriamiento y solidificación
Bajo condiciones normales, el punto de fusión de una sustancia es una propiedad característica. Sin embargo, en ciertas condiciones, puede ocurrir un fenómeno llamado superenfriamiento, donde una sustancia se enfría por debajo de su punto de fusión sin solidificarse. Este fenómeno ocurre cuando no hay nucleación para la formación de cristales.
En el caso de los sólidos amorfos, como los vidrios, la fusión ocurre de manera diferente. Estos materiales se forman cuando un material fundido se enfría rápidamente por debajo de su temperatura de transición vítrea, lo que impide la formación de una estructura cristalina regular. La fusión de estos sólidos amorfos se puede considerar como un proceso de filtración a través de las conexiones rotas entre las partículas.
La fusión es un proceso físico en el cual un sólido se convierte en líquido al aumentar su energía térmica. Este proceso está influenciado por la temperatura, la presión y la composición química del sólido. Desde el punto de vista termodinámico, la fusión es una transición de fase de primer orden. Sin embargo, existen algunas excepciones a este comportamiento. Además, bajo ciertas condiciones, puede ocurrir superenfriamiento, donde una sustancia se enfría por debajo de su punto de fusión sin solidificarse.